乳腺癌作为一种在乳腺组织中常见的恶性肿瘤,近10年来其发病率和死亡率呈逐渐上升趋势,已成为全球女性健康亟待解决的重大问题[1]。当前治疗手段涵盖手术切除肿瘤、放疗、化疗、激素治疗和靶向治疗等,旨在根治或控制疾病进展。其中三阴性乳腺癌(TNBC)恶性程度高,既往以化疗为主要治疗手段,预后较差。
目前,已发现多种新型的药物靶点,“精准治疗”、“分类而治”正在改变TNBC的临床实践,新的治疗领域的发展为突破TNBC治疗难点带来了希望。本次《医师报》特邀浙江省肿瘤医院乳腺内科主任医师黄圆教授就TNBC的治疗困境与新方案展开探讨,以期为临床实践提供参考。
分子分型决定治疗难题
TNBC现有诊疗方案单一局限
分子分型是指对乳腺癌进行基因和蛋白水平检测,根据雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER2)几个关键指标将乳腺癌分为激素受体(HR)阳性、HER2阳性、TNBC三类,HR阳性乳腺癌是最主要的乳腺癌类型,约占患者总数的70%,相对于其他分型,HR阳性乳腺癌生长速度更慢,转移风险较低,治疗结果相对较好; HER2阳性乳腺癌约占乳腺癌群体20%-30%,这类患者肿瘤生长速度较快,复发风险较高,属于疗效较差的乳腺癌类型,但近年来抗HER2药物的出现,显著改善了患者的治疗效果;若ER、PR和HER2均为阴性,则称为TNBC,约占所有乳腺癌的15%-20%,其中少见的低级别特殊类型如分泌性癌、腺样囊性癌等预后相对较好,而高级别类型如梭形细胞化生性癌和基底细胞样癌等预后较差。目前TNBC对内分泌或靶向治疗均不敏感,临床治疗仍以化疗为主,但复发转移风险较高,且复发后治疗手段有限,被认为是最“凶猛”的乳腺癌,亟需探寻新型诊疗方案以打破治疗困局[2]。
晚期TNBC新进展迭代更新
免疫治疗联合化疗提高患者获益
随着基因组学的发展和对TNBC分子分型的深入研究,针对BRCA基因突变的PARP抑制剂和针对免疫检查点抑制剂的免疫药物正在改变TNBC的临床实践,尤其是Ⅲ期KEYNOTE-355研究证实了帕博利珠单抗联合化疗能为PD-L1 CPS≥10的晚期TNBC患者带来明显生存获益[3],在PD-L1 CPS≥10亚组中,帕博利珠单抗组的中位总生存期(OS)为23.0个月,帕博利珠单抗的客观缓解率(ORR)达52.7%,缓解的中位持续时间为12.8个月。基于这一成果,免疫联合化疗已经成为晚期TNBC的重要一线治疗选择(图1)。
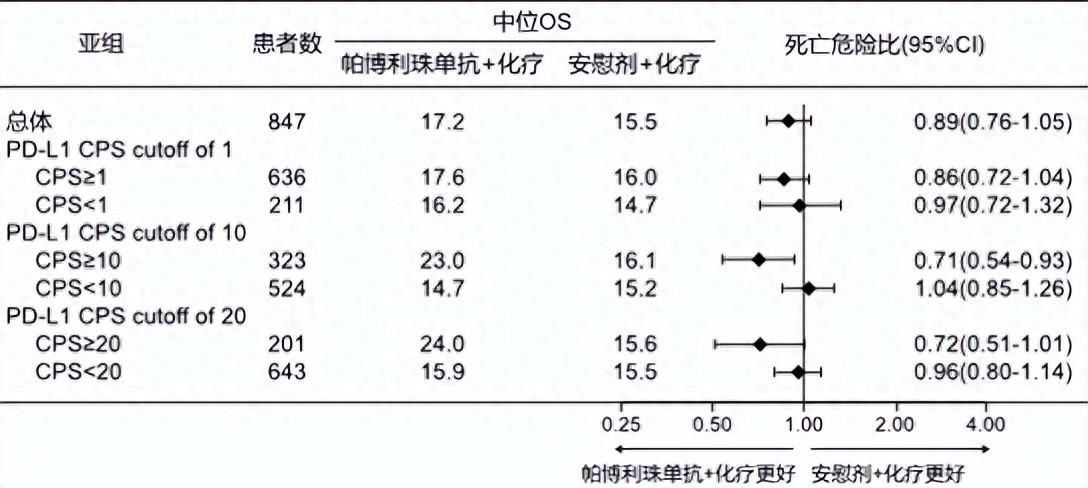
图1 帕博利珠单抗联合化疗治疗PD-L1 CPS≥10晚期TNBC患者的中位OS
随着临床研究的不断深入,新型抗体药物偶联物(ADC)药物在乳腺癌中取得了诸多进展,对于二线以上相对后线的患者而言,ADC不失为一个有效选择。TROP2靶向ADC在一定程度上打破人群筛选的界限,为更多TNBC患者带来新的治疗希望,作为首个靶向TROP2获批用于治疗晚期TNBC的药物戈沙妥珠单抗(SG),具有高特异性和高效杀伤,可以实现精准高效清除癌细胞,目前已有研究支持SG在TNBC的应用价值[4]。约1/3的HER2阴性患者表现为HR-/HER2低表达,HER2-ADC德曲妥珠单抗(T-Dxd)在HR-/HER2低表达的晚期TNBC中进行了探索性研究,数据显示T-Dxd可降低患疾病进展或死亡风险,具有显著生存获益,目前已相关获批适应证[5]。此外,针对BRCA基因突变的PARP抑制剂奥拉帕利亦可有效提高TNBC患者的生存获益,与化疗相比,奥拉帕利组患者的中位OS从17.1个月延长到19.3个月(图2)[6]。
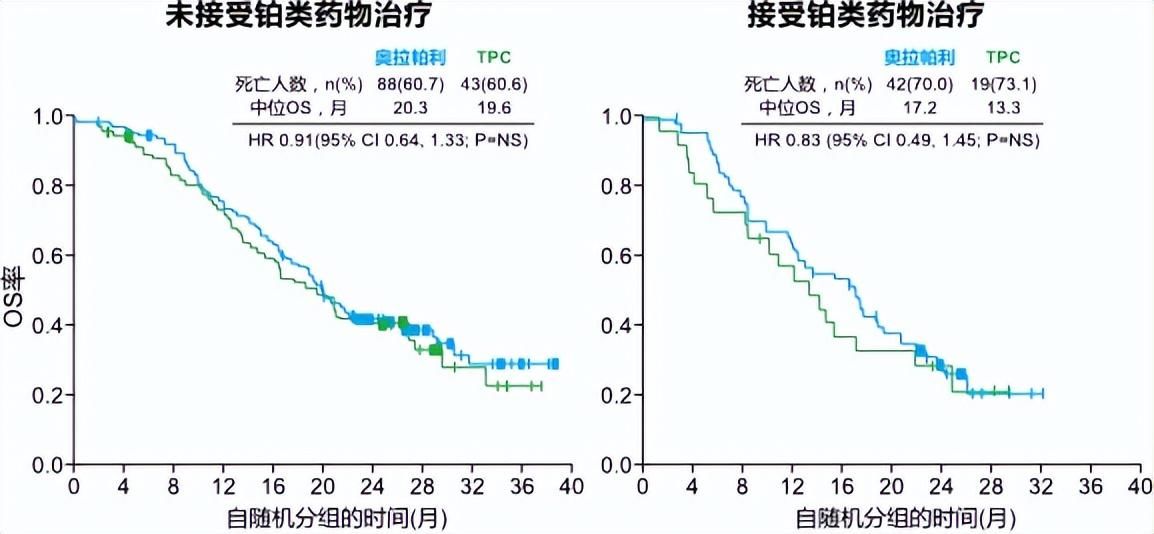
图2 相较于化疗,PARP抑制剂奥拉帕利可有效改善患者的中位OS
“复旦分型”指导精准治疗
新方案赋能个体化治疗
肿瘤的治疗模式日趋个体化,选用精准的治疗方案,对于TNBC患者而言具有重要意义。TNBC异质性较高,即使是同样的临床分期和治疗方案,不同类型的TNBC患者治疗效果也不完全一样。为实现精准治疗,2016年复旦大学附属肿瘤医院的邵志敏教授及团队提出了TNBC“复旦分型”基于4个临床常用免疫组化标志物(AR、CD8、FOXC1、DCLK1),将TNBC分为4个不同的亚型:免疫调节型(IM)、腔面雄激素受体型(LAR)、基底样免疫抑制型(BLIS)、间质型(MES)[7]。2019年该团队进一步验证了“复旦分型”的准确性,并揭示基于分子分型的靶向药物选择是TNBC精准治疗的重要依据:对于BLIS建议使用铂类和PARP抑制剂;对于IM建议使用免疫治疗;对于LAR建议抗HER2、CDK4/6抑制剂治疗;对于MES建议抗肿瘤干细胞、抗血管生成治疗[8]。
浙江省肿瘤医院乳腺内科也是秉持着精准治疗的原则,着重考虑患者自身情况,个体化选择免疫、靶向、ADC等药物进行排兵布阵,助力实现患者最大获益。
黄圆教授总结
虽然TNBC是一种恶性程度高、易复发转移且预后差的乳腺癌亚型,但当前已有多种治疗方案带来了治愈生机。临床治疗过程中应基于患者的分子分型,结合患者个体情况选择合适治疗方案,保障患者的生存获益和生活质量。TNBC治疗之路仍道阻且艰,增强已有的免疫应答、克服免疫治疗获得性耐药、识别患者不同的独特基因表型并制定个体化的治疗组合仍是未来需进一步解决的问题。
专家简介

黄圆 教授
浙江省肿瘤医院乳腺内科主任医师
肿瘤学博士、副教授、硕士生导师
长江学术带乳腺联盟常委
中国女医师协会乳腺专业委员会委员
中国健康促进基金会乳腺癌专委会委员
浙江省抗癌协会肿瘤内科专委会青年委员
浙江省免疫学会肿瘤免疫与生物治疗专委会青年委员
主持国家自然科学基金、浙江省自然科学基金等课题5项
参考文献(向上滑动查看):
[1] Huang, J.J., Chan,et al. Global Incidence and Mortality of Breast Cancer: A Trend Analysis. Aging (Albany NY), 2021,13, 5748-5803.
[2] 邢爱艳,高鹏.三阴性乳腺癌分子分型研究进展[J].中华病理学杂志, 2022, 51(1):5.
[3] Cortes Javier,Rugo Hope S,Cescon David W et al. Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer.[J] .N Engl J Med, 2022, 387: 217-226.
[4] Kalinsky K, Spring L, Yam C, et al. Real-World Use Patterns, Effectiveness, and Tolerability of Sacituzumab Govitecan for Second-Line or Later Treatment of Metastatic Triple-Negative Breast Cancer. 2023 ESMO 393P.
[5] Modi S, Jacot W, Iwata H, et al. Trastuzumab deruxtecan (T-DXd) versus treatment of physician’s choice (TPC) in patients (pts) with HER2-low unresectable and/or metastatic breast cancer (mBC): UpDate: survival results of the randomized, phase 3 DESTINY-Breast04 study. 2023 ESMO 376O.
[6] Robson M E, Tung N, Conte P, et al. OlympiAD final overall survival and tolerability results: Olaparib versus chemotherapy treatment of physician’s choice in patients with a germline BRCA mutation and HER2-negative metastatic breast cancer[J]. Annals of Oncology, 2019, 30(4): 558-566.
[7]Jiang Y Z, Ma D, Suo C, et al. Genomic and transcriptomic landscape of triple-negative breast cancers: subtypes and treatment strategies[J]. Cancer cell, 2019, 35(3): 428-440. e5.
[8]Wang L, Lang G T, Xue M Z, et al. Dissecting the heterogeneity of the alternative polyadenylation profiles in triple-negative breast cancers[J]. Theranostics, 2020, 10(23): 10531.
友情提示
本站部分转载文章,皆来自互联网,仅供参考及分享,并不用于任何商业用途;版权归原作者所有,如涉及作品内容、版权和其他问题,请与本网联系,我们将在第一时间删除内容!
联系邮箱:1042463605@qq.com